Сила кислоты определяется её способностью диссоциировать (вызывать разделение) и отдавать катион (положительно заряженный ион) водорода. Сильные кислоты распадаются полностью, активно реагируют с другими веществами, а слабые лишь частично разлагаются на водород и кислотный остаток, а затем соединяются обратно. Чем обусловлена эта способность и что такое суперкислоты, рассказываем в статье.
Прежде всего, начать нужно с определения кислот.
Кислоты – это химические соединения, которые состоят из одного или нескольких атомов водорода, всегда имеющих положительный заряд, и отрицательно заряженного иона – кислотного остатка: нитрата, сульфата, хлорида.
Проще говоря, их химическая формула всегда начинается с H – водорода и выглядит как H+KO, где KO – кислотный остаток. Из школьного курса химии вы наверняка помните, что водород одновалентен, то есть способен отдавать только один электрон, приобретая положительный заряд.
Почему «остаток», если это, по сути, большая часть молекулы? Это соединение, которое теряет протон H+ в результате химической реакции. За счёт этого оно может взаимодействовать с другими веществами.
Какие бывают кислоты

Если в молекуле кислоты один атом водорода, то такая кислота называется одноосновной. К ним можно отнести соляную HCl и бромистоводородную HBr.
Если в формуле кислоты вы видите 2 атома водорода – это двухосновная кислота. Пример таких кислот – серная H2SO4 и сероводородная H2S.
Если же атомов водорода 3, кислоту называют трёхосновной. Борная H3BO3 и ортофосфорная H3PO4 – трёхосновные кислоты.
Но из этого правила есть и исключения. Например, H3PO4, ортофосфорная кислота – трёхосновная. А фосфористая, H3PO3, тоже с тремя атомами водорода, но она – двухосновная, поскольку в её молекуле один из них относится к кислотному остатку. Та же история с фосфорноватой кислотой H3PO2, она – одноосновная, хотя водорода там столько же, сколько и в ортофосфорной.
Получается, что основность кислоты зависит от валентности кислотного остатка.
Кроме того, кислоты делят на кислородсодержащие и бескислородные. Бескислородные состоят из водорода и неметалла (сероводородная H2S, соляная HCl), в кислородсодержащих, соответственно, содержится один или несколько атомов кислорода (серная H2SO4, азотная HNO3).
И, наконец, кислоты бывают сильными и слабыми.
Разница между ними в том, насколько легко они теряют водород в результате химических реакций.
Слабые кислоты диссоциируют, но не полностью. Или всё же распадаются, но потом соединяются обратно. К ним можно отнести фтороводородную HF и сероводородную H2S, синильную HCN, хлорноватистую HClO, хлористую HClO2, угольную H2CO3 и кремниевую H2SiO3 кислоты.
У сильных же происходит необратимый распад. Образуется много катионов водорода и анионов кислотного остатка, способных вступать во взаимодействие с другими веществами. Пример сильных кислот – йодоводородная HJ, соляная HCl, бромистоводородная HBr, азотная HNO3, серная H2SO4, хлорноватая HClO3 и хлорная HClO4.
Как отличить сильную кислоту от слабой
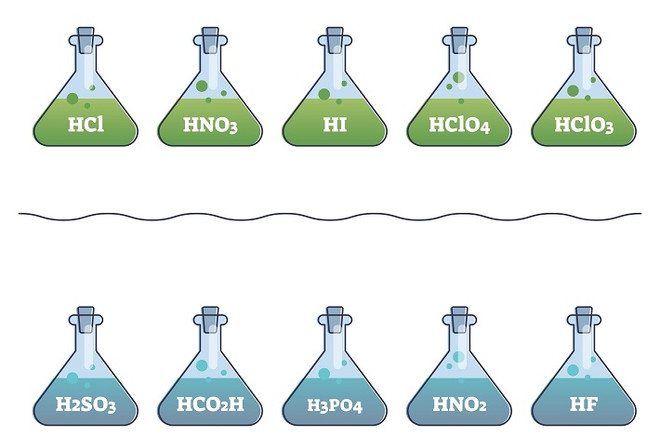
В случае с бескислородными кислотами проще запомнить: йодоводородная, соляная и бромистоводородная – это сильные. Все остальные – слабые.
Для кислородсодержащих есть хороший способ отличить одни от других по химической формуле. Для этого нужно вычесть из количества атомов кислорода в молекуле количество водорода. Если в результате получается число меньше 2, то кислоту можно отнести к слабым. Если разность больше или равна 2, то она – сильная.
Для примера возьмём хлористую HClO2 и хлорную HClO4 кислоты.
В хлористой – два атома кислорода и один атом водорода.
2 – 1 = 1
Хлористая кислота – слабая.
Что касается формулы хлорной кислоты, то мы видим, что водород в ней один, а кислорода – целых 4 атома.
4 – 1 = 3
То есть хлорная кислота – сильная.
Почему сильные кислоты легко теряют водород
Если брать бескислородные кислоты, то их сила зависит от радиуса атома неметалла, то есть от числа его энергетических уровней. Сравним между собой фтороводородную и йодоводородную кислоты.
В таблице периодических элементов фтор стоит во втором периоде, а значит, и энергетических уровней у него 2. Ему легче образовать электронную пару, чем йоду, связь в ней довольно прочная. Йод же в таблице находится в пятом периоде, энергетических уровней у него 5. Радиус его атома больше, чем у фтора, поэтому связь в электронной паре слабее.
Элементы с меньшим количеством энергетических уровней и меньшим радиусом атома сильнее «держатся» за свои связи и сложнее их разрывают. Фтор «жадничает», не полностью диссоциируя и возвращая свой «законный» водород обратно. Йод гораздо легче расстаётся с протонами водорода при диссоциации. Именно поэтому фтороводородная кислота слабее (хотя и считается средней), чем йодоводородная.
В кислородсодержащих кислотах из-за наличия кислорода эта взаимосвязь немного сложнее. В данном случае сила кислоты зависит в большей мере от степени окисления центрального элемента, то есть от того, сколько к нему присоединено атомов кислорода помимо гидроксильной группы OH.
Например, сила хлорсодержащих кислот падает по мере уменьшения атомов кислорода, прикреплённых к хлору. Образно говоря, у хлора не хватает сил удерживать все атомы вокруг себя, и он легче их теряет. В хлорноватистой кислоте к нему прикреплён один атом кислорода и один – водорода. Хлору легко их «держать», поэтому хлорноватистая кислота частично диссоциирует, образуя частицы H+ и ClO-, которые быстро воссоединяются обратно. Хлорноватистая кислота – слабая.

В молекуле хлористой кислоты HClO2 к хлору присоединены уже 3 атома – 1 водород и 2 кислорода. Здесь хлору уже приходится сложнее их удерживать, связь слабее, а кислотные свойства – сильнее. В хлорноватой кислоте HClO3 связей у хлора ещё больше, катион водорода теряется ещё легче. Самая сильная в этом ряду – хлорная кислота HClO4.
Какие кислоты считаются самыми сильными
Для измерения уровня кислотности обычно используют водородный показатель pH. Он указывает на количество ионов H+ в том или ином растворе. Но существуют такие кислоты, к которым значения pH применять очень сложно, поскольку они во много раз сильнее соляной и серной кислот. Их водородный показатель просто получается отрицательным. Такие соединения назвали супер- или сверхкислотами и для их изучения существует целый раздел науки – химия суперкислот.
Для измерения их окислительных свойств разработали ещё один показатель – функцию кислотности Гаммета, в которой за отправную точку взяли концентрированную серную кислоту. Её функция кислотности равна 11,93, а все вещества, показатели которых больше, – это и есть суперкислоты.
Так какие же кислоты самые сильные?
Серная кислота H2SO4
Серная кислота, которую взяли за эталон при изучении свойств суперкислот, при смешивании с водой даёт очень бурную реакцию. Если в концентрированную кислоту налить немного воды, смесь вскипает, выделяются газ и тепло. Причём вступает в реакцию она даже с парами воды – эту её особенность широко используют в промышленности для осушения газов. При контакте с кожей и слизистыми она вызывает очень сильные ожоги вплоть до некроза тканей. Применяют это соединение в разбавленном виде в производстве аккумуляторов, в очистке сточных вод, при переработке нефти и в сельском хозяйстве.
Соляная кислота HCl

Соляная кислота считается ещё более сильной, чем серная, поскольку способна диссоциировать полностью в отличие от H2SO4. Это вещество в низкой концентрации вырабатывается в желудке человека специальными железами и способствует перевариванию пищи, а также убивает болезнетворные бактерии, попадающие в пищеварительный тракт. Её применяют для очистки железа от ржавчины, травления стали в гальванопластике, в переработке руд, производстве поливинилхлорида и нефтяной промышленности.
Трифликовая кислота CF3So3H
Трифликовая, или трифторметансульфоновая, кислота – органическая. Она была синтезирована в 1954 году, а сейчас используется в научных исследованиях в качестве катализатора и в фармакологической промышленности при производстве антибиотиков, стероидов и витаминов. Легко реагирует с водой.
Фторсерная кислота HSO3F
Фторсерную (она же фторсульфоновая) кислоту получают путём соединения оксида серы SO3 и фтороводородной кислоты HF. Выглядит она как бесцветная жидкость, которая дымится при контакте с воздухом. В воде частично распадается на фтороводородную и серную кислоты, поэтому водный её раствор способен разрушать не только органические вещества, но и металл и стекло. Её применяют при производстве пластика, полимеров и бензинов с высоким октановым числом.
Хлорная кислота HClO4

Концентрированная хлорная кислота взрывоопасна. Её соли и эфиры – перхлораты – применяются при производстве ракетного топлива, фейерверков, спичек, а также для изготовления аккумуляторов. Некоторые из перхлоратов используют в медицине для лечения патологий щитовидной железы и в качестве противорадиационного препарата.
Карборановая кислота H(CB11Cl11)
Карборановая кислота почти в миллион раз сильнее эталона – концентрированной серной. Она с лёгкостью отдаёт катион водорода, но при этом её кислотный остаток очень стабилен, он не вступает в дальнейшую реакцию. Эта кислота практически не вызывает коррозии, не повреждает стекло, но при контакте с кожей ожоги всё-таки оставляет. Сейчас она в большей степени используется в научных исследованиях.
Магическая кислота FSO3H.SbF5
Магическая кислота создана путём соединения двух составляющих – фторида сурьмы и фторсульфоновой кислоты. В данный момент считается, что это самая сильная кислота. А волшебной или магической её назвали из-за её способности растворять парафины, когда в 1966 году сотрудник лаборатории частного исследовательского университета в США показал фокус с растворением свечи в этом веществе. Сейчас её в основном используют для стабилизации ионов углерода в растворах.



